Les cellules souches jouent un rôle primordial pour le développement et l’équilibre de notre organisme. Les deux grandes propriétés de ces cellules sont de pouvoir se multiplier (on parle d ’« auto renouvellement ») et de changer d’identité pour se spécialiser (on parle de « différenciation »). Mieux comprendre la balance qui permet aux cellules de rester souches ou de se différencier est fondamental pour la médecine régénérative mais également la biologie du cancer. En effet, la dérégulation de cet équilibre peut conduire à une multiplication incontrôlée des cellules et au développement de tumeurs
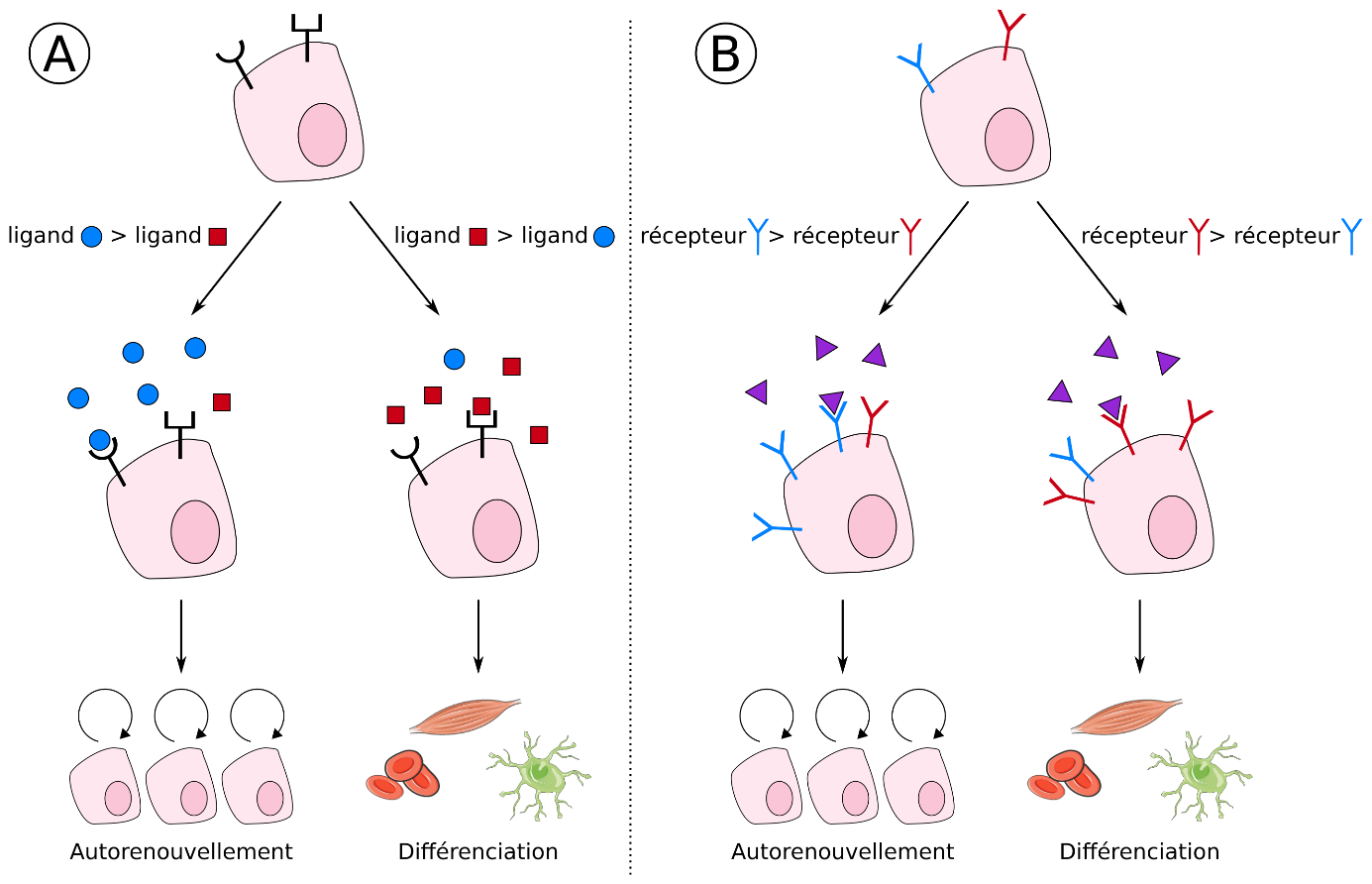
Le devenir d’une cellule souche est dicté par des molécules sécrétées (relarguées dans son environnement). Ces molécules, dites « de signalisation », sont des ligands qui se fixent à des récepteurs à la surface de la cellule pour transmettre une information. Au cours des dernières décennies, la communauté scientifique a élaboré un modèle dans lequel la proportion respective de signaux favorisant l’auto-renouvellement ou induisant la différenciation dicte le devenir d’une cellule souche donnée (Fig. 1A du schéma ci-dessous).
Cette étude apporte ainsi un regard nouveau sur le contrôle du destin des cellules souches, ouvrant des perspectives pour la médecine régénérative et le cancer. Elle a été publiée dans la prestigieuse revue Nature Cell Biology le 30 mars 2020.

Dans ce contexte, l’équipe « Reprogrammation, cellules souches et oncogénèse » dirigée par Fabrice Lavial, chercheur Inserm au sein du Centre de Recherche en Cancérologie de Lyon (CRCL) et menant ses recherches sur le site du Centre Léon Bérard, vient de démontrer que la molécule sécrétée Nétrine-1, connue pour être surexprimée dans de nombreux cancers, constitue également un signal d’autorenouvellement des cellules souches embryonnaires (CSE).
Alors que cette protéine avait été initialement décrite pour guider les axones du système nerveux, les chercheurs ont montré qu’elle était présente à des stades bien plus précoces du développement embryonnaire et qu’elle participait activement à l’émergence des cellules souches. Grâce à ces résultats, l’équipe a ensuite pu mettre au point les conditions expérimentales pour améliorer les conditions de culture des cellules souches embryonnaires en ajoutant cette molécule dans le milieu de culture.
Les chercheurs ont enfin découvert que les cellules souches embryonnaires expriment à leur surface deux récepteurs à la Nétrine-1 différents, appelés Unc5b et Neogenin. En modulant expérimentalement la quantité respective de chacun de ces récepteurs sur une cellule souche embryonnaire, ils ont démontré de manière inattendue que ce même ligand, la Nétrine-1, peut induire deux décisions diamétralement opposées :
- soit l’auto-renouvellement,
- soit la différenciation de la cellule.
Dans ce nouveau modèle de destin cellulaire, la stœchiométrie des récepteurs (leur quantité respective) devient un élément aussi important que la nature du ligand lui-même (Fig. 1B). Ce nouveau concept pourrait être applicable à d’autres couples de ligand/récepteurs ainsi qu’à un grand nombre de cellules souches normales ou pathologiques, et donc ouvrir des perspectives fascinantes pour la médecine régénérative et le cancer.
Figure 1 : Modèles alternatifs du contrôle du devenir des cellules souches. (A) Le modèle précédemment établi par la communauté scientifique implique que la quantité relative de ligand pro-auto-renouvellement (rond bleu) et prodifférenciation (carré rouge) dicte le devenir de la cellule souche. (B) Le modèle élaboré par l’équipe de Fabrice Lavial propose qu’un même ligand (Nétrine-1, triangle violet) peut promouvoir les 2 destins cellulaires et que c’est la stœchiométrie des récepteurs pro-auto-renouvellement (bleu) et prodifférenciation (rouge) qui dicte le devenir de la cellule.